文献分享 | Nature Communications | CD36介导的肿瘤细胞和巨噬细胞之间的代谢串扰影响肝转移
大家好!为大家介绍一篇2022年10月发表在Nature Communications的文章,题目为“CD36-mediated metabolic crosstalk between tumor cells and macrophages affects liver metastasis”。本文主要揭示了肿瘤细胞与肿瘤微环境中巨噬细胞代谢相互作用的机制,并提出了靶向CD36作为肝转移免疫疗法的治疗潜力。本文通讯作者是来自于重庆医科大学的陈压西教授和阮雄中教授,陈压西教授主要从事代谢性炎症、脂质代谢紊乱与器官损害的研究,阮雄中教授主要从事代谢性炎症与脂代谢紊乱介导的组织器官损害机制研究。

背景介绍
转移是癌症死亡的主要原因,而肝脏是其中最常见的部位。肝转移具有高度侵袭性和难治性,通常与预后不良、治疗反应降低有关。研究者们开发了一系列利用免疫系统对抗肿瘤的癌症免疫疗法,已在治疗多种恶性肿瘤方面取得了进展。但是,由于巨噬细胞会在肝转移中大量积累,从而影响免疫治疗的结果,而靶向巨噬细胞可以有效改善免疫治疗肝转移的效果。巨噬细胞是浸润肿瘤微环境(TME)中最丰富的骨髓细胞,能够促进肿瘤的发生、发展和转移。巨噬细胞的功能重编程是一个复杂的过程,其通过代谢过程适应局部TME、葡萄糖、脂质和谷氨酰胺代谢变化,这些变化塑造了具有免疫抑制和抗炎活性的肿瘤促进表型。肿瘤内巨噬细胞发生了大量脂质积累,有利于用脂肪酸来促进线粒体氧化磷酸化。
由于肿瘤细胞的高代谢活性,TME通常会表现出缺氧、酸度和营养消耗的特征。而肿瘤相关代谢物会影响TME的组成和肿瘤浸润免疫细胞的功能。研究表明,肿瘤中脂质代谢的激活提供了丰富的脂质代谢产物,导致肿瘤发展和局部TME富集。此外,肿瘤相关巨噬细胞的免疫抑制表型会受到长链脂肪酸(LCFAs)代谢控制。
设计思路
肝转移具有高度侵袭性和难治性,其主要原因包括巨噬细胞介导的免疫抑制。利用肿瘤微环境(TME)因子驱动免疫抑制的机制是癌症免疫治疗的一种有效策略。作者通过荧光标记和超速离心方法,研究了肿瘤细胞中长链脂肪酸(LCFA)的运输途径以及运输方式。接着,作者通过脂质组分和细胞能量代谢分析,研究了转移相关巨噬细胞(MAMs)的脂质组分以及其对肿瘤活动的影响。最后,作者利用小鼠模型进行敲除实验,研究了肿瘤-巨噬细胞代谢界面的调整对肝转移情况的影响,未来可以考虑作为临床治疗肝转移的一种有效策略。
数据介绍
为了评估肿瘤细胞外在微环境中的CD36是否会对肝转移产生影响,作者将具有高转移效力的LLC细胞脾内注射到Cd36−/−小鼠和其WT同胎小鼠(图1a)。与WT小鼠相比,Cd36−/−小鼠肝脏的转移性肿瘤受到很大程度的抑制(图1a-d),从而证实能够排除宿主CD36对调节肿瘤细胞粘附或外渗的影响。此外,组织学分析显示,与WT小鼠相比,Cd36−/−小鼠的肿瘤细胞凋亡没有明显变化,但肿瘤细胞增殖和血管生成减少(图1e-g)。上述数据表明,宿主CD36的表达对肿瘤细胞在肝脏中的定植至关重要。
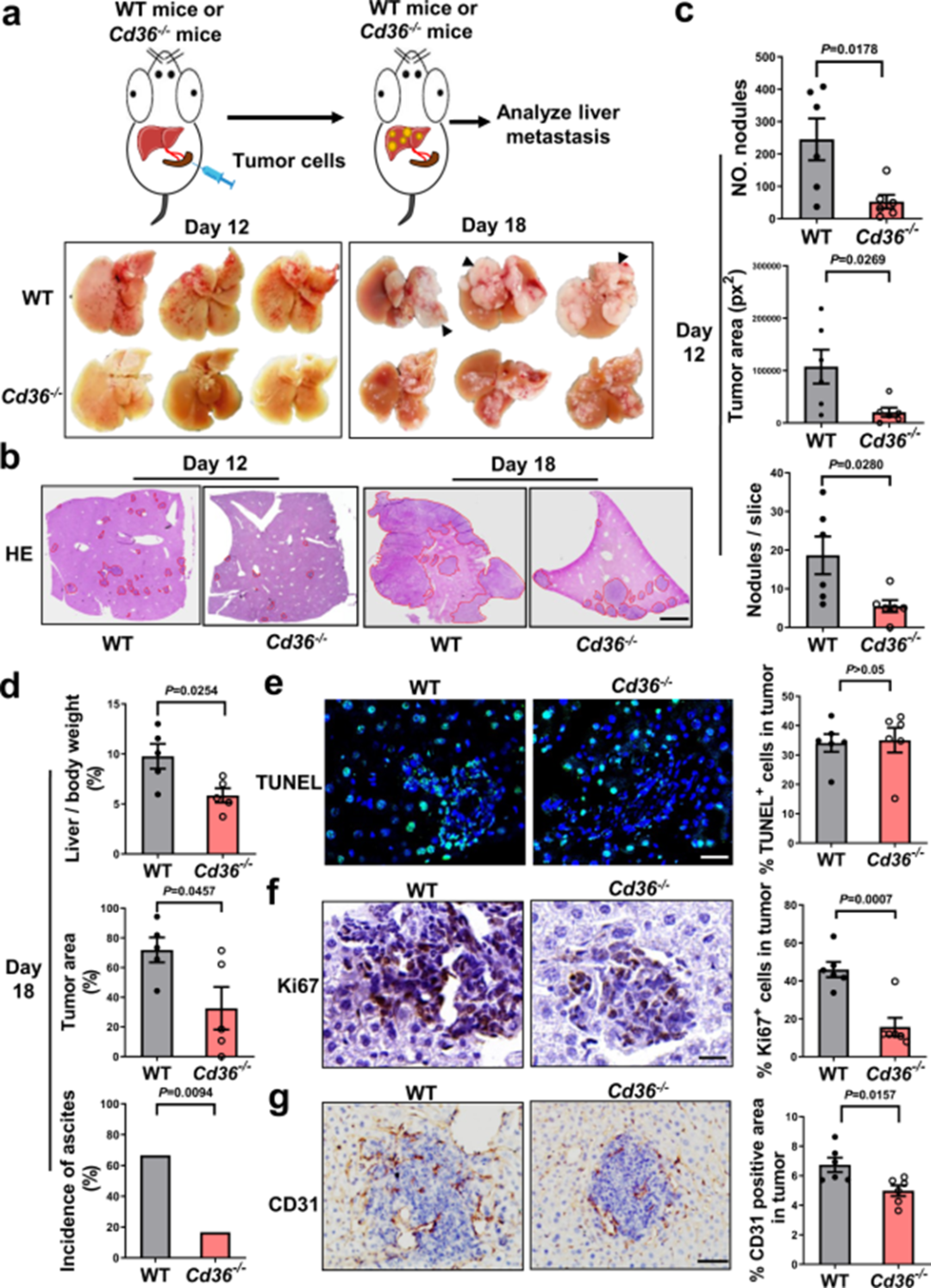
图1 宿主CD36表达促进肿瘤向肝脏转移
根据图2a所示,小鼠肝脏中,CD36在巨噬细胞(CD45+CD11b+GR1−F4/80+)中表达最高水平,在肝细胞中处于中等水平,在其他免疫细胞中处于低水平,包括中性粒细胞(CD45+CD11b+GR1+)、B细胞(CD45+CD3−CD19+)、T细胞(CD45+CD3+CD19−NK1.1−)、NK细胞(CD45+CD3−NK1.1+CD19−)和NKT细胞(CD45+CD3+NK1.1+CD19−)。通过分析外周血单核细胞(PBMCs)和肝脏的单细胞测序数据,作者证实PBMCs中的单核细胞和肝脏免疫细胞中巨噬细胞CD36的高表达(图2b)。已有相关研究表明,肝细胞中CD36在维持代谢和免疫稳态方面起着至关重要的作用。因此,作者使用了Cd36lko小鼠来评估肝细胞CD36对肝转移形成的影响,肝脏中LLC或B16F10细胞的转移瘤生长在Cd36lko小鼠及其同胎小鼠之间无显著差异(图2c)。氯膦酸盐脂质体可以抑制肝转移的转移相关巨噬细胞(MAMs)耗竭,而在使用氯膦酸盐脂质体进行治疗后,WT小鼠和Cd36−/−小鼠在肝转移方面无显著差异(图2d)。相较于对照小鼠,Cd36lysm-cre小鼠(巨噬细胞中不存在CD36)的肝转移明显受到抑制,表现为肝脏重量减轻、肿瘤负担减轻、肿瘤细胞增殖受抑制(图2e-g)。上述数据表明,CD36以MAM依赖性方式有效促进肝转移。
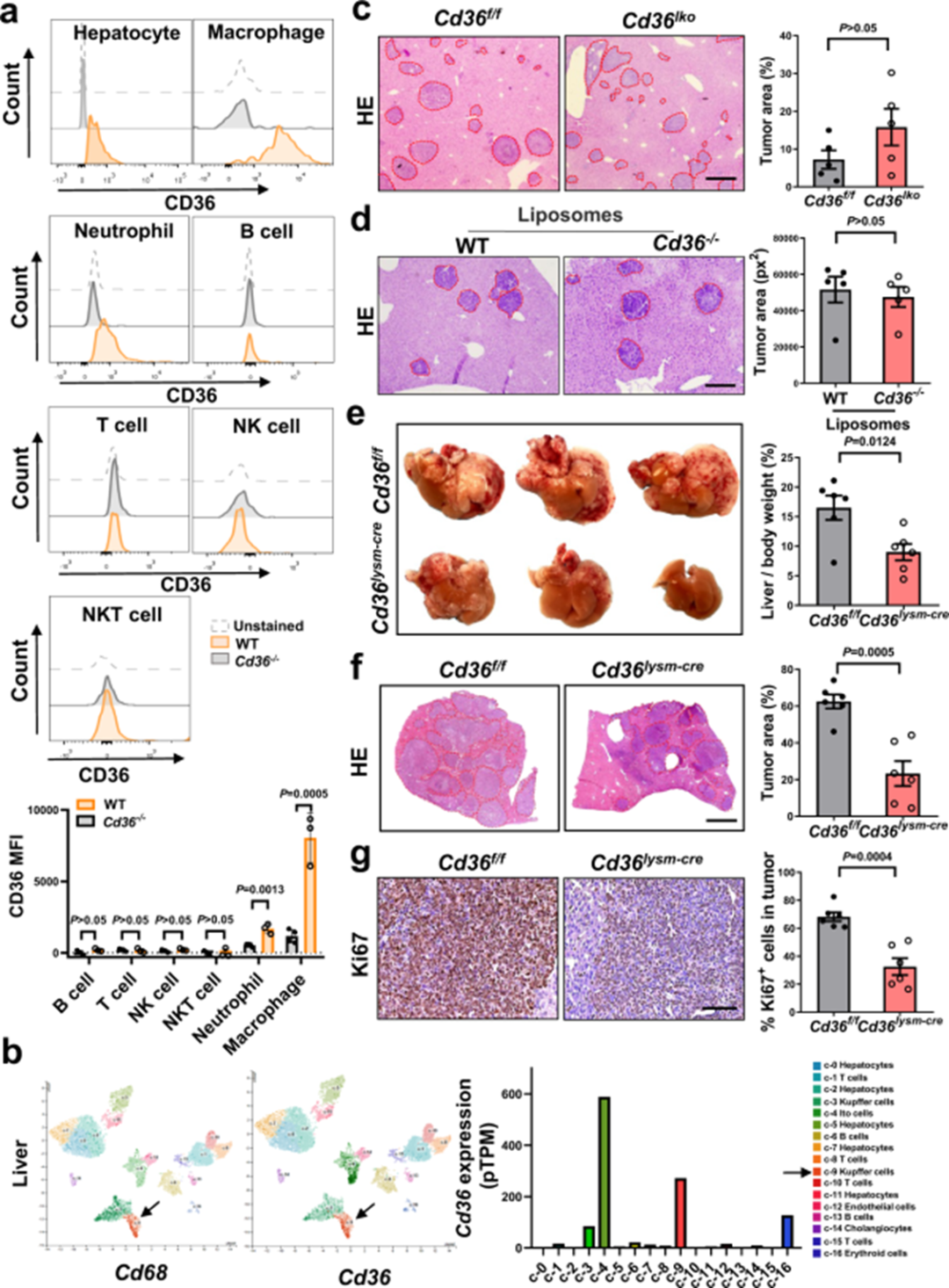 图2 MAM中CD36的遗传消融抑制肝转移
图2 MAM中CD36的遗传消融抑制肝转移
为了响应TME,巨噬细胞经历代谢重编程,从而影响其功能表型。从转移性肝肿瘤中分离出的MAMs比从正常肝脏中分离的天然巨噬细胞含有更多的脂滴(图3a)。在体外,肿瘤细胞刺激的BMDMs显示出典型的脂质负载表型(图3b-c)。脂质分析显示,与肿瘤细胞共培养的BMDMs中甘油三酯(TG)和甘油二酯(DG)水平显著增加(图3d-e)。因此,相较于对照组,肿瘤刺激BMDMs的线粒体呼吸作用明显增强(图3f)。重要的是,与肿瘤相关的MAMs和BMDMs比其正常对照组具有更高的吸收LCFAs的能力(图3g-h)。正如预期,与天然巨噬细胞相比,肿瘤相关MAMs和BMDMs中CD36的表达增加(图3i-l)。巨噬细胞由不同的亚群组成,在肿瘤中具备专门的功能。对CD36表达的进一步分析显示,在MAMs或BMDMs中,CD206high亚群的表达水平高于CD206low亚群(图3m),这表明CD36在原细胞M2样巨噬细胞中具有独特的表达模式。上述结果表明,CD36介导的脂质摄取可能是导致MAMs中脂质沉积和免疫功能障碍的关键因素。
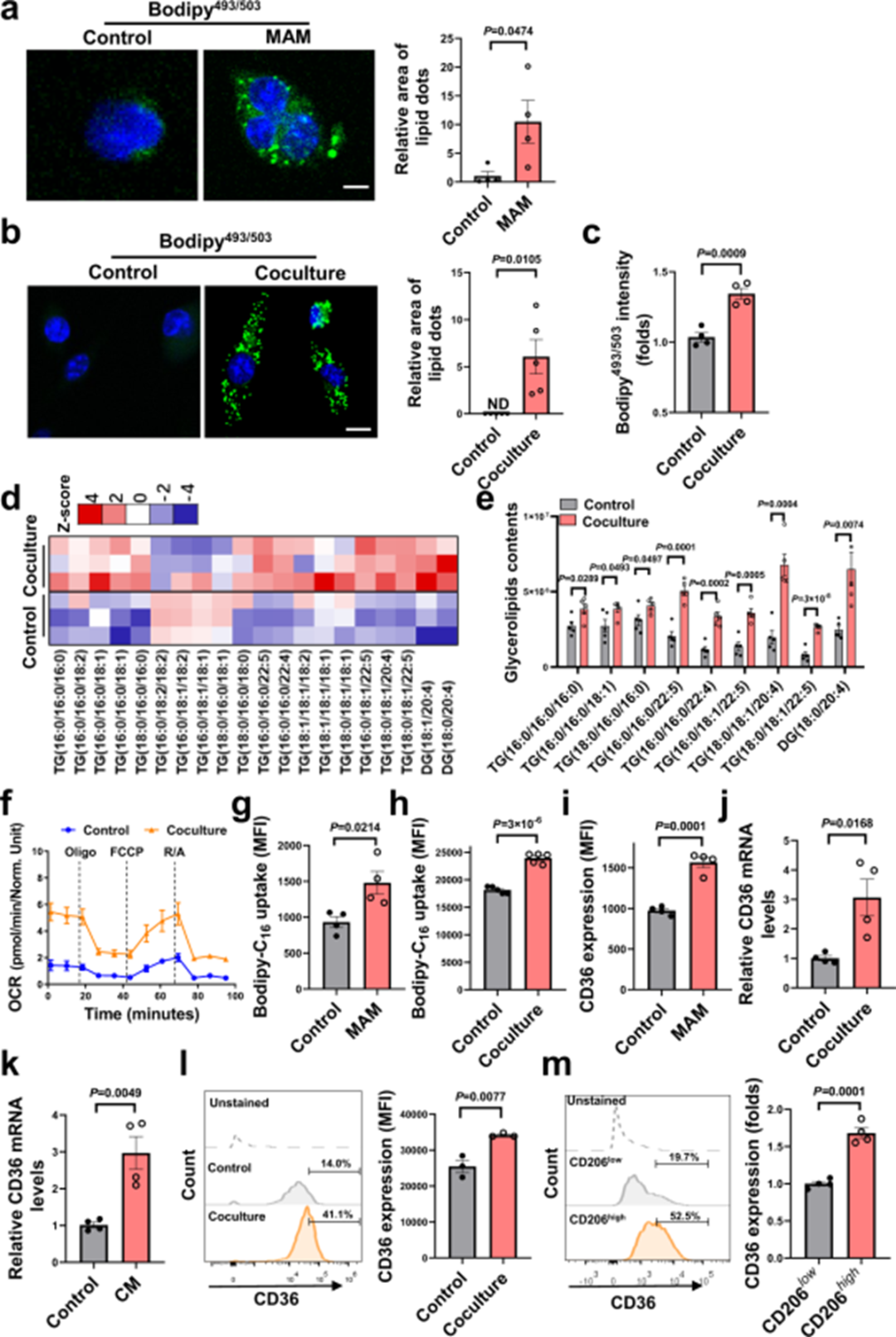 图3 MAMs表现出脂质沉积增加和CD36高表达
图3 MAMs表现出脂质沉积增加和CD36高表达
最近一项研究表明,脂肪酸优先分化成肿瘤细胞,这表明循环脂肪酸对巨噬细胞的可及性是有限的。因此,作者使用脂质脉冲追踪试验来测试肿瘤细胞是否将其储存的脂质转移到巨噬细胞,将肿瘤细胞在和巨噬细胞共培养前与荧光标记的LCFA(BODIPY-C16)预孵育(图4a)。流式细胞术分析结果表明,无论肿瘤或巨噬细胞类型,共培养后巨噬细胞中的荧光信号稳定增加,但在肿瘤细胞中以时间依赖性方式降低(图4b-c)。原本只存在于肿瘤细胞的标记脂质在巨噬细胞中检测到,并在直接或间接共培养后形成脂质液滴状结构(图4d-f)。在共培养之后,主要定位于脂滴的荧光LCFA随着时间的推移重新分布到巨噬细胞中的线粒体中(图4g)。这些结果表明,肿瘤来源的脂质可以转运到巨噬细胞中进行氧化。作者还研究了肿瘤细胞将储存的脂质转移到巨噬细胞中的方式。作者使用100 kDa过滤器将肿瘤条件培养基(TCM)分成两部分,以区分游离脂肪酸(<100 kDa)和携带脂肪酸的载体(>100 kDa)。其中,>100 kDa的组分在巨噬细胞中诱导荧光信号与TCM效果相近,而使用<100 kDa的组分处理的巨噬细胞中检测到少量荧光信号(图4h-i)。此外,作者使用离心法从TCM中分离获得细胞外囊泡,并发现在10000g或100000g离心后巨噬细胞与微球孵育后检测到荧光信号(图4j)。结果表明肿瘤细胞主要是通过释放富含脂质的囊泡将其脂质转移到巨噬细胞。
 图4 巨噬细胞吸收肿瘤细胞释放的外源性脂肪酸
图4 巨噬细胞吸收肿瘤细胞释放的外源性脂肪酸
CD36在肿瘤浸润免疫细胞亚群中的表达模式与这些细胞吸收肿瘤来源的脂质模式相关,由此作者提出了CD36介导脂质富集小泡摄取的可能,CD36可以与磷脂酰丝氨酸相互作用并介导囊泡的吞噬。在体内,肿瘤来源的细胞外囊泡转移到CD3缺陷的巨噬细胞的效率较低(图5a)。当体外缺乏CD36时,巨噬细胞对肿瘤来源脂质的内化显著降低(图5b-c)。此外,当体内缺乏CD36时,BODIPY-C166从癌细胞向MAMs的转移明显减少(图5d)。由此,作者推测,减少对肿瘤来源的脂质的接触将减少脂质沉积。实验结果符合预期,CD36的阻断抑制了肿瘤处理的巨噬细胞中的脂质沉积(图5e-g),相应地,Cd36−/−小鼠中肿瘤处理的巨噬细胞的线粒体呼吸下降(图5h)。为了更深入了解CD36在调节脂质代谢中的作用,作者使用非靶向LC-MS对WT和Cd36−/−BMDMs中的脂质代谢物进行了分析。与WT小鼠相比,来自Cd36−/−小鼠的肿瘤治疗BMDMs展现了明显的脂质组学特征。下调脂质主要富集于甘油脂的主要脂质类别,其中TG显著降低(图5i)。通过分析基于GC-MS的LCFA谱,在Cd36−/−小鼠的肿瘤处理巨噬细胞中观察到LCFA丰度显著降低,饱和脂肪酸和单不饱和脂肪酸种类减少(图5j),表明在Cd36−/−巨噬细胞中观察到的脂质组变化可能归因于肿瘤来源的LCFA的缺陷摄取。上述结果表明这些结果表明CD36是肿瘤源性脂质内化的关键调控因子,可能与肿瘤相关巨噬细胞脂质代谢的协调有关。
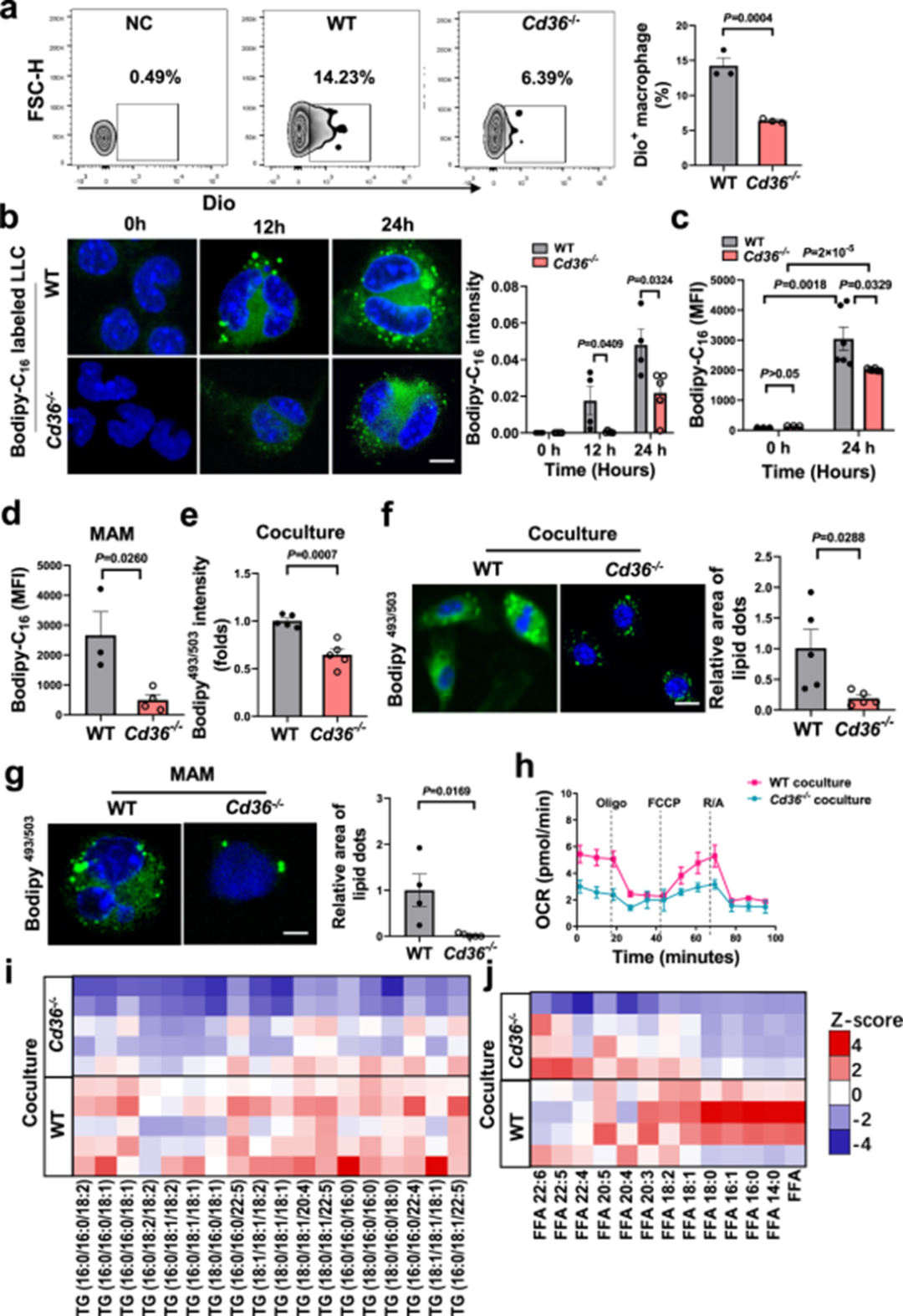 图5 CD36增加巨噬细胞中肿瘤细胞来源脂肪酸的摄取和脂质沉积
图5 CD36增加巨噬细胞中肿瘤细胞来源脂肪酸的摄取和脂质沉积
接着,作者研究了肿瘤来源的脂质是否会促进巨噬细胞转化为促进肿瘤的表型。对肝转移小鼠的GC-MS分析显示TME中有大量的LCFAs,通常是饱和的和单不饱和的LCFAs,故肿瘤共培养的巨噬细胞显示饱和和单不饱和LCFAs水平升高(图6a)。因此,作者评估了硬脂酸(SA,18: 0)和油酸(OA,18: 1)对巨噬细胞功能的影响。SA或OA处理增强了巨噬细胞M2的活化,在OA处理组中观察到更大变化(图6b-c)。与体外观察类似,饲料中添加脂肪增加了M2标记物的表达加速了小鼠肝转移的发展(图6d-e)。与喂食猪油(LD)的小鼠相比,喂食富含OA的橄榄油(OD)的小鼠有加重肝转移的趋势。这些数据表明,肿瘤细胞来源脂肪酸的获取,特别是单不饱和LCFA,诱导巨噬细胞向M2样表型激活。作者研究了CD36对巨噬细胞极化的影响。与WT BMDMs相比,在与肿瘤细胞或中药孵育后,Cd36−/− BMDMs表达较低的M2标志物(Arg1,Cd206,Il-10),但表达较高的M1标志物(Il-12,Tnfα)(图6f-g)。与WT BMDMs相比,肿瘤治疗Cd36−/− BMDMs对CD8 T细胞的抑制作用减弱(图6h-i)。这些结果表明,巨噬细胞在通过CD36依赖性机制从肿瘤细胞中吞噬脂质后被赋予促进肿瘤的表型。
 图6 阻断CD36可减少巨噬细胞M2极化
图6 阻断CD36可减少巨噬细胞M2极化
作者进一步研究了CD36在肝脏TME中的功能。图7a表明,除了Cd36−/−肝脏中B细胞的增加,正常WT和Cd36−/−的免疫细胞谱没有显著差异。肿瘤细胞植入后,MAMs是第12天浸润的主要成分,而髓源性抑制细胞(MDSC)是第18天浸润的主要成分,但T细胞、B细胞和NK细胞的频率随着时间的推移而下降。与WT小鼠相比,Cd36−/−小鼠在第12天和第18天的MAMs含量显著下降,在第18天B细胞的比率增加。免疫组织化学染色显示Cd36−/−小鼠转移灶中MAMs减少(图7b)。流式细胞术分析还显示Cd36−/−小鼠中MAMs的CD206表达下调和CD80表达增加(图7c-d)。作者继而对从Cd36lysm-cre小鼠及其同胎小鼠中分离出的肿瘤浸润免疫细胞进行了评估。作者观察到有LLC肝转移的Cd36lysm-cre小鼠表现出MAMs的频率降低,但B细胞和T细胞的频率增加(图7e)。进一步分析Cd36+lysm-cre小鼠的MAMs,与对照小鼠相比,CD206表达下调,表明M2样特征减少(图7f-g)。此外,从Cd36+lysm-cre小鼠分离的CD8T细胞显示GzmB和IFNγ的表达显著增加(图7h-i)。这些结果表明,MAMs中CD36的缺失可以增强CD8T细胞免疫力,从而达到抗肿瘤作用。在证明CD36在小鼠肝脏TME中的关键作用后,作者研究了CD36在人肝转移中的临床意义。在GES68468数据集中,CD36表达较高的患者M2型MAM的比例增加(图7j)。肝转移患者CD36表达与M2型MAM浸润呈显著正相关(图7k)。上述数据表明,CD36与小鼠和患者肝转移的免疫抑制模式有关,表明肝转移进展的潜在标志物。
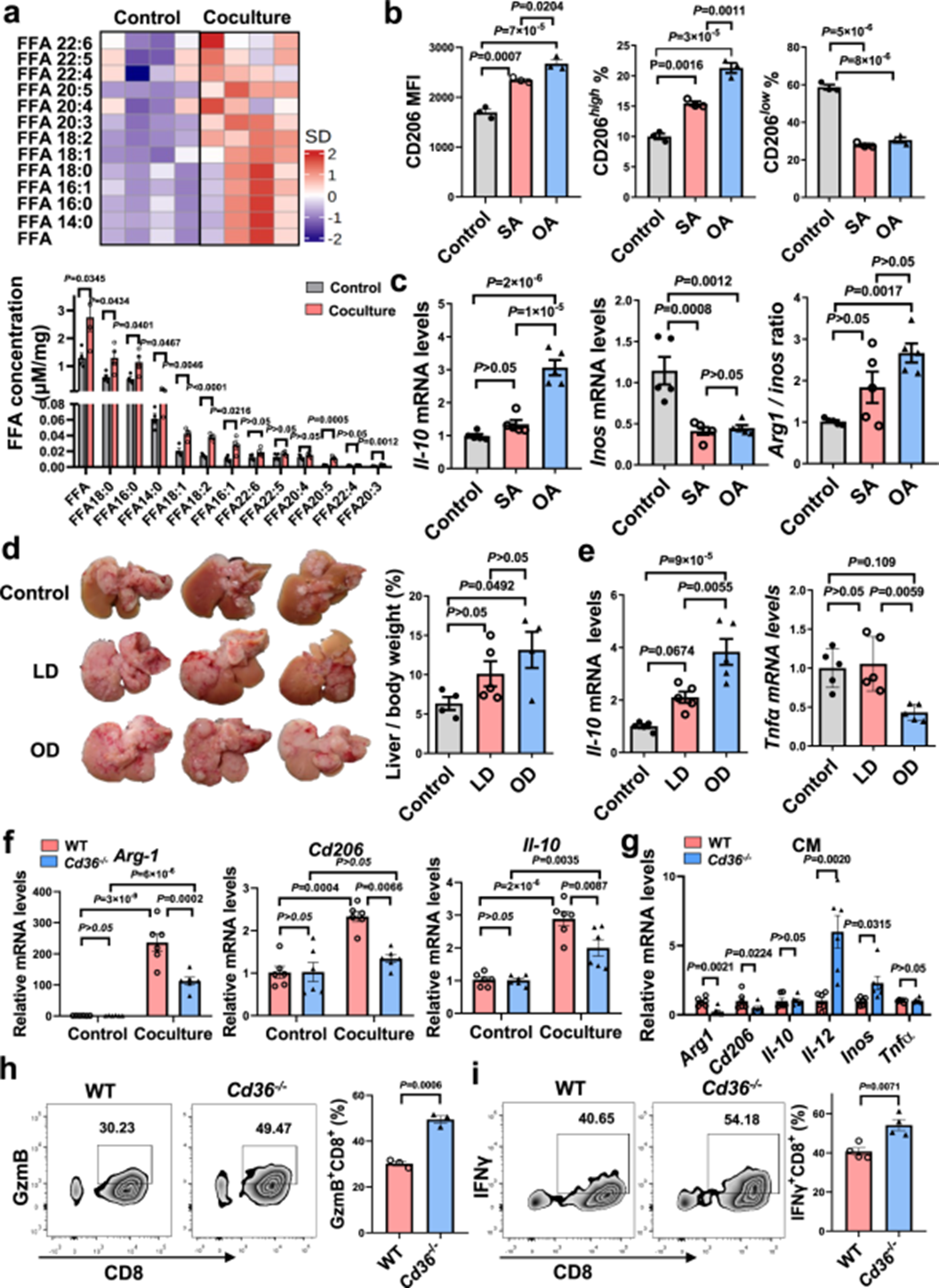 图7 CD36对肿瘤免疫的影响
图7 CD36对肿瘤免疫的影响
总结
综上,本研究发现清除受体CD36在MAMs中上调,并且MAMs中CD36缺失减弱了小鼠的肝转移。MAMs含有更多的脂滴,并具有吞噬肿瘤细胞衍生的长链脂肪酸的独特能力,这些脂肪酸由细胞外囊泡携带。富含脂质的囊泡优先通过CD36分化为巨噬细胞,为巨噬细胞提供燃料并触发其肿瘤促进活性。在肝转移患者中,CD36的高表达与前瘤M2型MAMs浸润相关,从而产生高度免疫抑制的TME。总的来说,该研究结果揭示了肿瘤细胞与TME中巨噬细胞代谢相互作用的机制,并提出了靶向CD36作为肝转移免疫疗法的治疗潜力。
原文链接
https://www.nature.com/articles/s41467-022-33349-y
撰稿人|岑诗芸
校稿人 | Chen Xin
扫一扫 手机端浏览
